Didattica di Scienze
Menu principale:
- Home
- Didattica
- Biologia 1
- Biologia 2
- Chimica
- Risorse
- Area riservata 1 anno
- Area riservata 4 anno
- Grandezze e U.M.
- Calore e Temperatura
- I gas
- La mole e Avogadro
- La tavola periodica
- Isotopi e Radioattività
- La fisica quantistica
- L'Atomo e gli Orbitali
- Le molecole e gli orbitali
- Nomenclatura chimica
- Soluzioni
- Chimica organica
- La chimica di tutti i giorni
- Scienze Terra
- Progetti
- PLS
- Bioform
- Progetto Bioform
- Scheda progetto 2014
- Scheda progetto 2013
- Congresso SIGU 2013
- Questionario feedback Bioform 2013
- Scheda progetto 2012
- Scheda progetto 2011
- Risultati 12/4/13
- Risultati 17/2/12
- Risultati 27/1/10
- PCR: ...in due parole
- PCR: diapositive
- PCR: simulazioni
- PCR: video
- Trasposoni
- Alu
- Link PCR
- Elettroforesi
- PCR e bufala
- PCR: ...in musica
- Area riservata Bioform
- Olimpiadi di Scienze
- Clonggio proteina GFP
- Progetto CERN
- Itinerari nel Lazio
Spettri a righe di emissione
Chimica > La fisica quantistica
Spettri a righe di emissione
Una sostanza gassosa a bassa pressione in un tubo in cui è stato fatto precedentemente il vuoto,, portata ad alta temperatura o sottoposta a scariche elettriche, emette luce (ad esempio una lampada a vapori di idrogeno). Se con uno spettroscopio si analizzano le radiazioni emesse, si osserva uno spettro formato da una serie di righe nette di colori diversi su uno sfondo nero e non il classico "arcobaleno".
Ogni elemento chimico allo stato atomico produce un proprio spettro a righe, diverso da quello di tutti gli altri che ne permette quindi l'identificazione. Il numero di righe e la loro lunghezza d'onda (corrispondente ciascuna ad un colore) dipendono dal tipo di elemento.
La spiegazione degli spettri a righe fu possibile solo dopo l' ipotesi di Max Planck (1858-1947), secondo il quale l'energia radiante non viene emessa oppure assorbita in modo continuo, ma per piccolissime quantità finite, discontinue, chiamate quanti. Ogni quanto di frequenza ![]() ha una energia E data dalla relazione:
ha una energia E data dalla relazione:
![]()
dove h è la costante di Planck e vale 6,625 x 10-34 Js.
L'osservazione e lo studio degli spettri di emissione a righe, soprattutto di quello dell'atomo di idrogeno, offrì a Niels Bohr (1885-1962) le basi per una interpretazione della struttura degli atomi che costituiscono la materia.
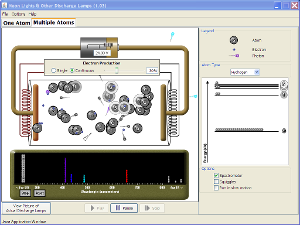
Qui di seguito una animazione che mostra la quantizzazione dell'energia e la formazione dello spettro a righe di emissione.
Esempi di spettri a righe di emissione di alcuni elementi:

Menu di sezione:
- Effetto fotoelettrico
- Spettri a righe di emissione ←
- Fisica quantistica
- Principio di indeterminazione